

日期:2024-03-22點擊:
2024年3月12日,中國科學技術大學生命科學與醫(yī)學部基礎醫(yī)學院、免疫應答與免疫治療重點實驗室朱書教授和潘文教授課題組合作在Immunity上發(fā)表了文章Bile acids modified by the intestinal microbiota promote colorectal cancer growth by suppressing CD8+ T cell effector functions,該項研究成果發(fā)現(xiàn)結直腸癌中微生物C. scindens介導的腫瘤免疫逃逸機制,并開發(fā)了基于噬菌體的干預方法,對特定結直腸癌患病風險人群的預防、特定結直腸癌患者的免疫治療及術后復發(fā)的控制皆有潛在意義。
結直腸癌是消化系統(tǒng)惡性腫瘤之一,其新發(fā)病例數(shù)在全世界男性、女性中分別排名第3位及第2位,死亡病例數(shù)在全世界男性、女性中分別排名第4位及第3位。結直腸癌在我國發(fā)病率逐年上升,在全部惡性腫瘤中發(fā)病數(shù)居第2位、死亡數(shù)居第4位。
結直腸癌的高發(fā)病率以及針對免疫治療的低響應率,亟需尋找其環(huán)境阻滯因素以尋找更精準有效的治療手段。眾所周知結腸部位最明顯的特征便是分布有巨量的腸道微生物,過去幾十年,研究人員發(fā)現(xiàn)傷寒桿菌(S. typhi)和聚合梭桿菌(F. nucleatum)均可通過活化Wnt/β-catenin通路成為結直腸癌的風險因素[1],但這僅僅是腸道存在的1013次方細菌對宿主影響的冰山一角。在今年1月發(fā)表的一篇Nature Cell Biology論文中,朱書課題組與山東大學初波課題組合作,發(fā)現(xiàn)結直腸癌患者腸道中厭氧消化鏈球菌(P. anaerobius)富集,P. anaerobius分泌色氨酸代謝物IDA,是AHR的天然配體,通過激活腸道上皮細胞ALDH1A3-FSP1-CoQ10軸抵抗鐵死亡,對腫瘤預后有不良影響。實際上,腸道不僅分布有大量上皮細胞,人體一半以上的免疫細胞、70%以上的T細胞都分布在腸道這個最大的黏膜免疫器官中。
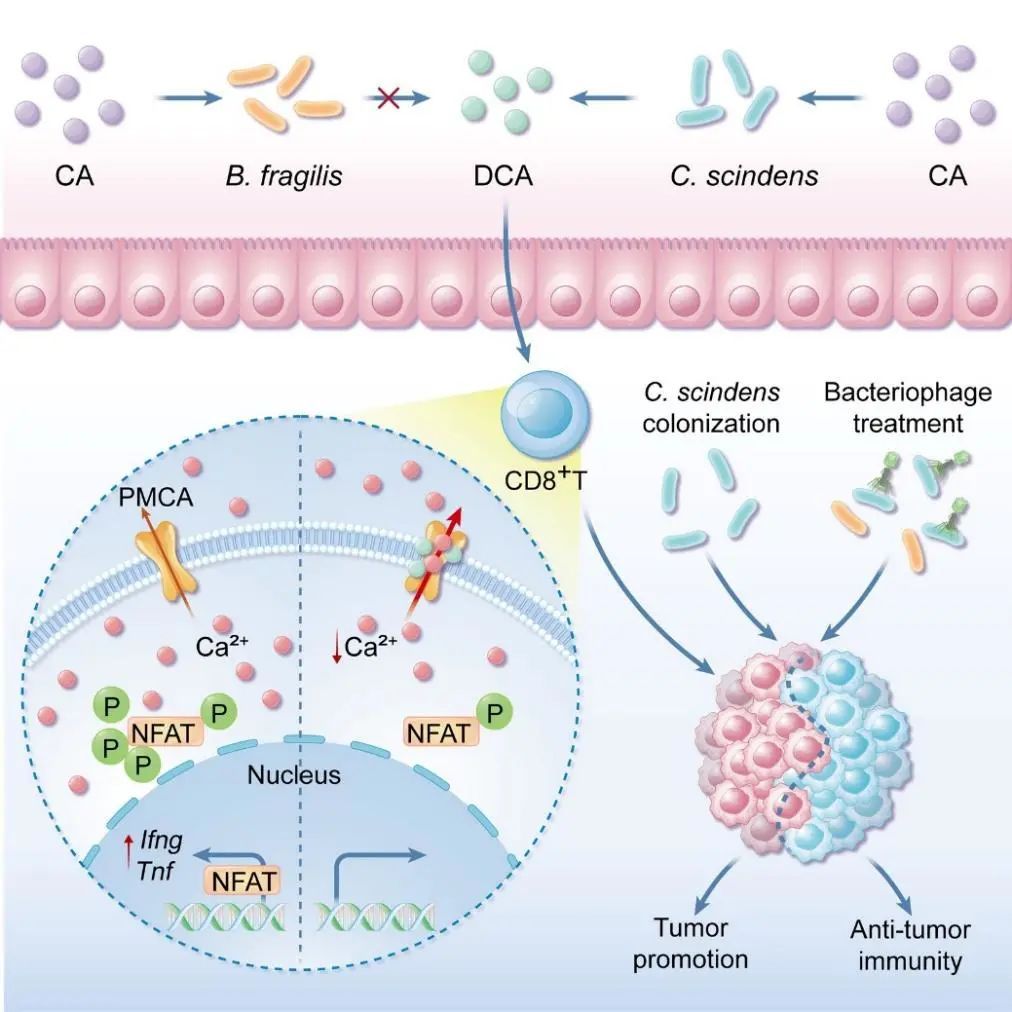
CD8+ T細胞是抵抗腫瘤的核心免疫細胞。在腫瘤發(fā)生早期,初始CD8+ T細胞接受抗原和共刺激信號,啟動TCR信號轉導,使得胞內Ca2+的濃度增加,轉錄因子NFAT入核啟動IFN-γ和TNF等效應分子轉錄表達,激活CD8+ T細胞。活化的CD8+ T細胞通過分泌細胞因子和釋放Granzyme B等途徑協(xié)助機體清除腫瘤細胞。結直腸癌發(fā)生后,腫瘤微環(huán)境中浸潤的CD8+T細胞功能異常,其浸潤數(shù)量和基因表達模式是結直腸癌的重要預后指標,其中高比例CD8+T細胞浸潤、高表達Granzyme B表征良好預后。然而,在結直腸癌腫瘤微環(huán)境中,CD8+T細胞功能異常是否與改變的腸道細菌/代謝物有關,以及何種細菌/代謝物影響CD8+T細胞抗腫瘤功能目前仍知之甚少。
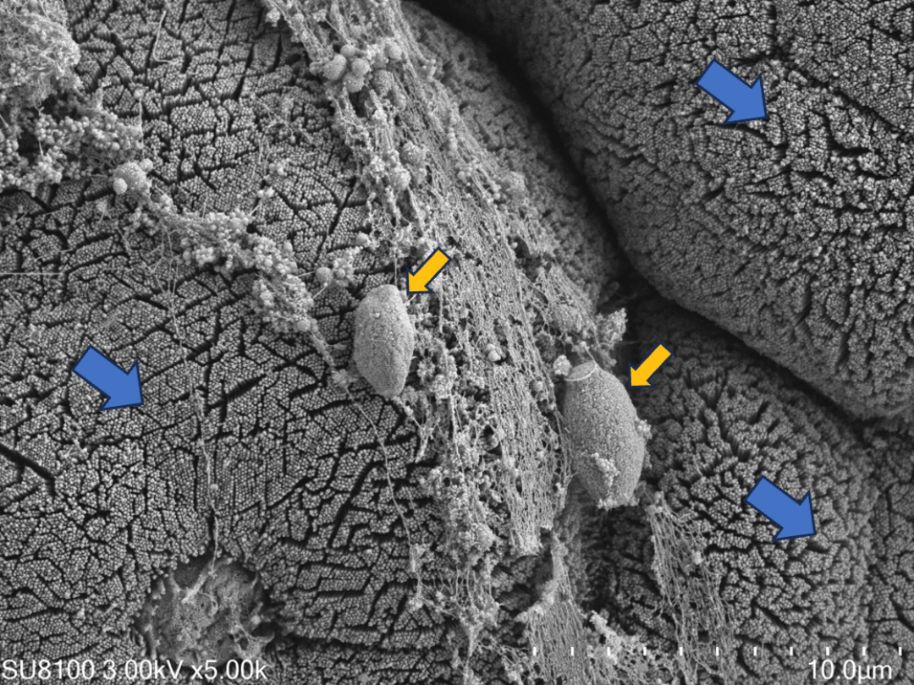
藍色箭頭:IECs;黃色箭頭:產DCA的梭菌屬
為尋找調控CD8+ T細胞抗腫瘤功能細菌/代謝物,研究團隊構建了腸道微生物來源的小分子代謝物庫,通過體外篩選和體內驗證,發(fā)現(xiàn)C. scindens通過bai operon產生的次級膽汁酸脫氧膽酸(DCA)可以有效抑制CD8+ T細胞的效應功能,并促進結直腸癌生長。進一步研究發(fā)現(xiàn),DCA可能是與細胞膜鈣泵PMCA結合,增強其活性,從而促進其介導的Ca2+外排,導致了胞漿內Ca2+濃度降低,抑制NFAT2激活,進而削弱CD8+ T細胞的效應功能。阻斷細菌DCA生物合成通路,可有效抑制細菌對CD8+ T細胞效應功能的抑制,從而阻斷DCA對小鼠腫瘤生長的影響。特異性靶向裂解C. scindens的噬菌體,可有效抑制C. scindens的免疫抑制以及促腫瘤效應。這項研究揭示了腸道微生態(tài)環(huán)境與腫瘤免疫微環(huán)境互作的新通路,為解除特定微生物帶來的對于免疫細胞的抑制進而對特定結直腸癌患病風險人群的預防、特定結直腸癌患者的免疫治療及術后復發(fā)的控制皆有潛在意義。
中國科大朱書和潘文教授為文章的共同通訊作者,朱書組博后叢靖婧(現(xiàn)為安徽醫(yī)科大學教授),潘文組博士生劉偏偏,朱書組博士生韓自莉,為本工作的共同第一作者。這個工作也獲得多位合作者的大力幫助:中科大孫林峰教授以及倉春蕾教授提供了DCA調控鈣泵活性、鈣離子成像的支持;深圳先進院戴磊教授、康奈爾大學郭春君教授、上海生化所宋昕陽研究員在微生物編輯及噬菌體篩選上提供了支持;哈佛大學Dennis Kasper教授和上海生化所宋昕陽研究員在排除DCA通過傳統(tǒng)受體影響CTL上提供了支持;上海長海醫(yī)院消化科柏愚主任、王樹玲醫(yī)生提供了CRC病人關聯(lián)性分析的支持。此外,中科大周榮斌教授、周叢照教授、以及陸軍軍醫(yī)大學葉麗林教授也提供了大量實驗支持和指導意見。
論文鏈接:https://doi.org/10.1016/j.immuni.2024.02.014
(生命科學與醫(yī)學部、科研部)